ストレスにさらされた昆虫個体の死に必要な遺伝子を発見


〇 研究代表者
筑波大学生存ダイナミクス研究センター
松村 崇志 助教
丹羽 隆介 教授
佐賀大学
早川 洋一 名誉教授
〇 研究の背景
ストレスとは、生物から生体反応を引き出す環境的または物理的な刺激です。自然界において
生物は、高温や低温、紫外線照射、あるいは社会における個体間相互作用など、さまざまなスト
レスに暴露されながら生きています。この際、許容範囲内のストレスであれば、そのストレスに
対する耐性を発揮することで生存できます。その一方で、受け止められる以上の過剰なストレス
(致死ストレス)を受けた場合は、個体は死に至ります。
致死ストレスによる個体死の原因は、一般に、ストレスに伴う全身的な恒常性の破綻に伴う受
動的なものと考えられていますが、昆虫や線虫を用いた近年の研究では、遺伝的メカニズムを利
用した能動的プロセスであることが示唆されています。しかし、それらの先行研究においても、
具体的にどのような遺伝子が個体死誘導の能動的メカニズムに関与するのかは、ほとんど解明さ
れていません。そこで、本研究グループは、遺伝学的ツールが充実しているキイロショウジョウ
バエ(以下、ショウジョウバエ)を用いて、ストレス誘導性個体死の制御遺伝子を探索しました。
〇 研究内容と成果
本研究ではまず、ショウジョウバエ幼虫の高温ストレスについて調べ、38℃以下では死亡しま
せんが、40℃以上の致死ストレスを受けた場合はすべての個体が死亡することを明らかにしまし
た。次に、この38℃の非致死ストレスと40℃の致死ストレス曝露後の幼虫の遺伝子発現変動を調
べるために、RNA-seq解析注1)を実施しました。その結果、致死ストレス曝露後4時間以内に発現
量が4倍以上の増加する遺伝子として、Phaedra1(以下、Phae1)を同定しました。Phae1は、酵
素であるキモトリプシン型セリンプロテアーゼ注2)をコードする遺伝子として知られています。
(図1)。
このPhae1の生理機能を詳細に解析したところ、Phae1の発現は、致死ストレス条件下において、
脳神経系において顕著に誘導されることが明らかになりました。そこで、神経系でのPhae1の生理
機能を解析するために、遺伝子発現誘導システムGAL4-UAS系注3)を活用し、神経細胞特異的に
Phae1の遺伝子発現量を操作しました。Phae1を過剰発現させると、細胞死誘導に必須の酵素カス
パーゼ3注4)の活性化を引き起こし、神経細胞死が誘導されました。一方で、致死ストレス環境下
でPhae1の発現を神経系全体で抑制した場合には致死ストレス後の脳神経系の細胞死が抑えられ、
個体死誘導が有意に抑制されました。従って、Phae1が、致死ストレスによって誘導される個体死
に重要な役割を担う、新規メディエーターであることが示唆されました。
一般に、ある遺伝子の発現は、遺伝子の近傍にあるエンハンサーと呼ばれるゲノム中の領域によ
って制御されます。そこで、Phae1の遺伝子発現量を制御する転写因子を同定するために、ゲノム
中のPhae1遺伝子の近傍DNA領域による遺伝子発現調節活性を検討しました。その結果、Phae1遺
伝子領域の上流540bp注5)から550bpの間のわずか10bpの領域を削除するだけで、Phae1遺伝子の
ストレス応答性が失われることが分かりました。すなわち、この10bpがストレス応答に必須のエ
ンハンサー領域であることが示唆されました。
多くの場合、エンハンサーには特定の転写因子注6)が結合し、その近傍の遺伝子発現が制御さ
れます。そこで、この10bpの領域の塩基配列情報を元にして、この配列に結合しうる転写因子を
既存のデータベースから検索したところ、転写因子Zesteの結合モチーフがヒットし、実際に生化
学的解析を行うと、Zesteタンパク質がPhae1のエンハンサー領域に直接結合することが確認され
ました。さらに、zesteの機能欠損変異体では、ストレスによって誘導されるPhae1の発現が顕著に
抑制され、致死ストレス後のショウジョウバエの生存率も有意に増加しました。以上の結果から、
ストレスによって誘導される個体死は、Zeste依存的に誘導されるPhae1によって制御されているこ
とが明らかとなりました。
加えて、Zeste依存的なPhae1の発現量を制御するシグナル経路を特定するために、低分子化合物
の阻害剤スクリーニングを行いました。その結果、シグナル伝達因子mTOR(mechanistic target of
rapamycin)の阻害剤として知られているラパマイシンを用いると、Phae1の遺伝子発現やストレ
ス誘導性の細胞死を抑制することが分かりました。また、神経系特異的にmTor遺伝子をノックダ
ウンしたショウジョウバエは、ZesteとPhae1のタンパク質レベルが低下し、致死ストレス後の生
存率が野生型の個体よりも高くなることも確認しました。すなわち、mTOR経路がZesteおよび
Phae1の発現を調節し、ストレス誘導性の個体死に関与していることが示唆されました(図2)
〇 今後の展開
本研究により、Phae1が神経細胞でのカスパーゼ3の活性化を介してストレス依存的個体死を誘
導することが明らかとなりました。今後は、ストレスによって誘導される個体死が遺伝学的制御
されている理由や、mTOR-Zeste-Phae1経路の個体に対する生物学的意義を追求していきます。
mTORが種を超えて広く保存されていること、昆虫以外の動物でもZesteやPhae1の類似構造を持
つ遺伝子が細胞死に関わっていること踏まえると、mTOR-Zeste-Phae1経路は動物全体で保存され
ている可能性があります。従って、Phae1を介した個体死制御機構の解明は、哺乳動物を含む動物
の個体死制御メカニズムの理解に貢献できると期待されます。また、mTOR-Zeste-Phae1経路が昆
虫の個体死を直接制御していることから、新規殺虫剤の開発などにも活用できる可能性があります。
【参考図】
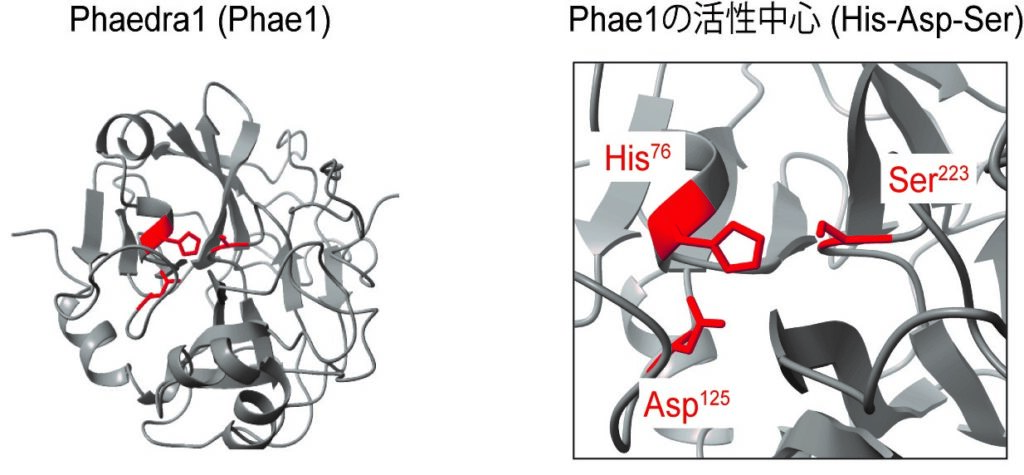
図 1 : Alphafold2(タンパク質の構造を予測する AI プログラム)を⽤いて予測したショウジョウ
バエPhaedra1(Phae1)の立体構造。Phae1は典型的なセリンプロテアーゼの活性中心(セリン、ア
スパラギン酸、ヒスチジン)を持つ。
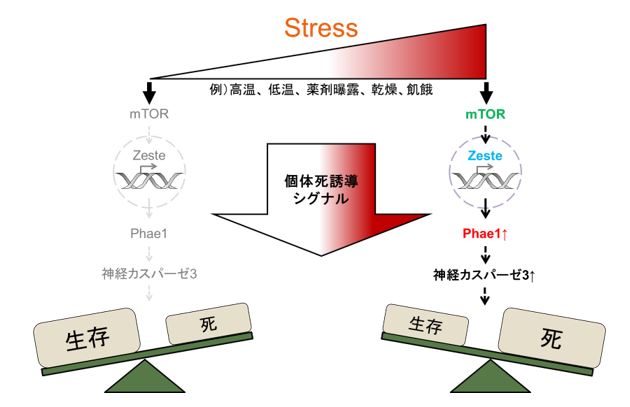
図2 : 本研究で明らかになった個体死誘導シグナルの概略図。許容範囲内のストレスであれば、ZesteやPhae1のタンパク質発現量は低い状態が保たれ、個体は生存することができる(左側)。一方、致死ストレスを受けた際には、mTOR-Zeste-Phae1経路が神経細胞でのカスパーゼ3活性化を介して細胞死を誘導し、個体死に至る(右側)。
【用語解説】
注1) RNA-seq (mRNA sequencing)
遺伝子発現変化を網羅的に解析する手法。特定の条件下での生物個体、組織、細胞からRNAを抽出
し、次世代シークエンサーを用いて遺伝子の発現量を解析する。
注2) プロテアーゼ(protease)
タンパク質を分解する酵素。活性中心の触媒残基によって、セリンプロテアーゼやシステインプロ
テアーゼなどのグループに分類される。キモトリプシンはセリンプロテアーゼのグループに含まれ
る。
注3) GAL4-UAS系(GAL4-UAS system)
ショウジョウバエの遺伝子発現誘導システムの一つ。組織特異的に遺伝子の強制発現やノックダウ
ンを行うために用いられる。
注4) カスパーゼ(caspase)
細胞死に関わるシステイン型プロテアーゼ(酵素)の一群であり、動物で広く保存されている。
カスパーゼ3は細胞死を執行する機能を持つため、エフェクターカスパーゼとも呼ばれる。
注5) bp(base pair)
DNAの長さの単位。塩基対(base pair)の数で表す。
注6) 転写因子(transcription factor)
遺伝子発現を制御するタンパク質。DNAの中の、遺伝子の転写量を高めるエンハンサー領域内に存
在する結合モチーフと呼ばれる配列に結合し、転写を開始させる。
【研究資金】
本研究は、日本学術振興会科学研究費助成事業 特別研究員DC2研究奨励費「昆虫のストレス応答
性の解析」(19J12272), 同 特別研究員PD研究奨励費「昆虫の致死ストレスに対する応答性の分子生
理遺伝学的解析」(22KJ0339)、同 若手研究「昆虫におけるプログラムされた個体死の分子遺伝学的
解析」(24K18156)、文部科学省共同利用・共同研究システム形成事業~学際領域展開ハブ形成プログ
ラム~(JPMXP1323015486)、熊本大学発生医学研究所共同研究(K24-15)の支援により実施されま
した。
【掲載論文】
[題 名] Stress-induced organismal death is genetically regulated by the mTOR-Zeste-Phae1 axis.
(ストレス誘導性個体死はmTOR-Zeste-Phae1軸によって遺伝的に制御されている)
[著者名] Takashi Matsumura (松村 崇志、筑波大学生存ダイナミクス研究センター、助教)
Masasuke Ryuda (龍田 勝輔、佐賀大学総合分析実験センター、助教)
Hitoshi Matsumoto (松本 均、佐賀大学農学部応用生物科学科、博士研究員)
Takumi Kamiyama (上⼭ 拓⼰、筑波大学生存ダイナミクス研究センター、助教)
Kyoko Jinnai (陣内 響子、東京理科大学生命システム工学部博士後期課程(当時))
Shu Kondo (近藤 周、東京理科大学生命システム工学部、准教授)
Akira Nakamura (中村 輝、熊本大学発生医学研究所、教授)
Yoichi Hayakawa (早川 洋一、佐賀大学農学部応用生物科学科、名誉教授)
Ryusuke Niwa (丹羽 隆介、筑波大学生存ダイナミクス研究センター、教授)
[掲載誌] Proceedings of the National Academy of Sciences
[掲載日] 2025年9月9日
[DOI] 10.1073/pnas.24270141
〇 問い合わせ先
【研究に関すること】
丹羽 隆介(にわ りゅうすけ)
筑波大学 生存ダイナミクス研究センター 教授
TEL: 029-853-5348
E-mail: ryusuke-niwa@tara.tsukuba.ac.jp
URL: https://sites.google.com/view/niwa-lab-tsukuba
【取材・報道に関すること】
筑波大学広報局
TEL: 029-853-2040
E-mail: kohositu@un.tsukuba.ac.jp
佐賀大学広報室
TEL: 0952-28-8153/0952-28-8921
E-mail: sagakoho@mail.admin.saga-u.ac.jp