反応途中の酵素を観る新手法の開発 ~光をあてて温度を変えるだけ!~




![]()
兵庫県立大学大学院理学研究科の城宜嗣特命教授、久保稔教授、武田英恵(大学院生研究当時)、理化学研究所(理研)放射光科学研究センター生命系放射光利用システム開発チームの當舎武彦専任研究員、佐賀大学堀谷正樹准教授、神戸大学木村哲就准教授らの共同研究グループは、生体触媒である酵素の反応途中を観るための新手法を開発し、一酸化窒素還元酵素(NOR)[1]の反応機構の解明に迫りました。本研究で開発した手法は、生体内で機能する様々な酵素に適用可能であり、高効率で行われる酵素反応の仕組みを理解することに貢献すると期待できます。
酵素は生体内において代謝や生合成に関わる化学反応を温和な条件下で行うことができる優秀な触媒です。そのため、酵素が持つ高効率の仕組みを解明することは、生命現象の理解だけでなく、高機能の触媒を設計するうえでも重要です。酵素が機能する仕組みを理解するためには、酵素の反応途中にみられる反応中間体[2]を観測することが必要になります。しかし、酵素の反応中間体は、マイクロ秒からミリ秒(1/1,000,000~1/1,000秒)程度の短い時間で消失してしまうため、その観測は、容易なことではありません。
今回、共同研究グループは、光照射により基質が放出されるケージド化合物[3]を用いて酵素の反応中間体を捕捉・観測する新手法を開発しました。液体窒素温度(約-200℃)でケージド化合物に光を照射し、基質を放出させた後、温度を-110℃程度まで上げると酵素と基質がゆっくりと反応し、反応中間体を捕捉できるという手法です。この手法を用いて、これまでの実験では、一瞬で消失してしまうNORの反応中間体を捕捉・観測することに成功しました。
本研究は、アメリカ化学会誌「The Journal of Physical Chemistry B」に1月5日(現地時間)に掲載されました。
われわれの体の中では、多くの化学反応が行われ、生物が生きていくために必要な化合物が合成されたり、不必要なものが分解されています。これらの化学反応を生体内という温和な条件下で効率良く行っているのが酵素と呼ばれるタンパク質になります。そのため、酵素がどのようにして効率良く化学反応を行っているのか理解することは、生命現象を理解することにとどまらず、高性能な触媒を設計するためにも重要になります。
酵素が働く仕組みを理解するためには、酵素が働いている途中で瞬間的に形成される反応中間体を観測することが重要になります。しかし、反応中間体は、マイクロ秒からミリ秒(1/1,000,000~1/1,000秒)という短い時間で消失してしまうため、その観測は簡単なことではありません。
これまで、酵素の反応中間体を観測するための手法として、酵素溶液と基質溶液を素早く混合して、その直後の状態を観測する混合法が用いられてきました。しかし、この方法では、酵素溶液と基質溶液の混合に時間がかかるため、素早く消失してしまう反応中間体の観測が困難でした。本共同研究グループは、この状況を打破するために、光の照射により基質を放出するケージド化合物を利用することで光照射により酵素反応が開始される系を開発し、フェムト秒の赤外レーザーを活用して一瞬で消失してしまう反応中間体の赤外分光スペクトルの測定に成功してきました(温室効果・オゾン層破壊の原因である亜酸化窒素の生物的発生機構の解明:https://www.sci.u-hyogo.ac.jp/news/puresuririsu_kubominoruR030518.pdf)。このようにケージド化合物を利用した手法は、反応中間体の観測に有効なのですが、この手法を行うには、自作の計測装置を開発する必要がありました。このような装置開発には膨大な研究費がかかるだけでなく、測定のために非常に高度な技術の取得も必要となります。そこで、より簡便に酵素の反応中間体を観測する計測手法の開発がのぞまれていました。
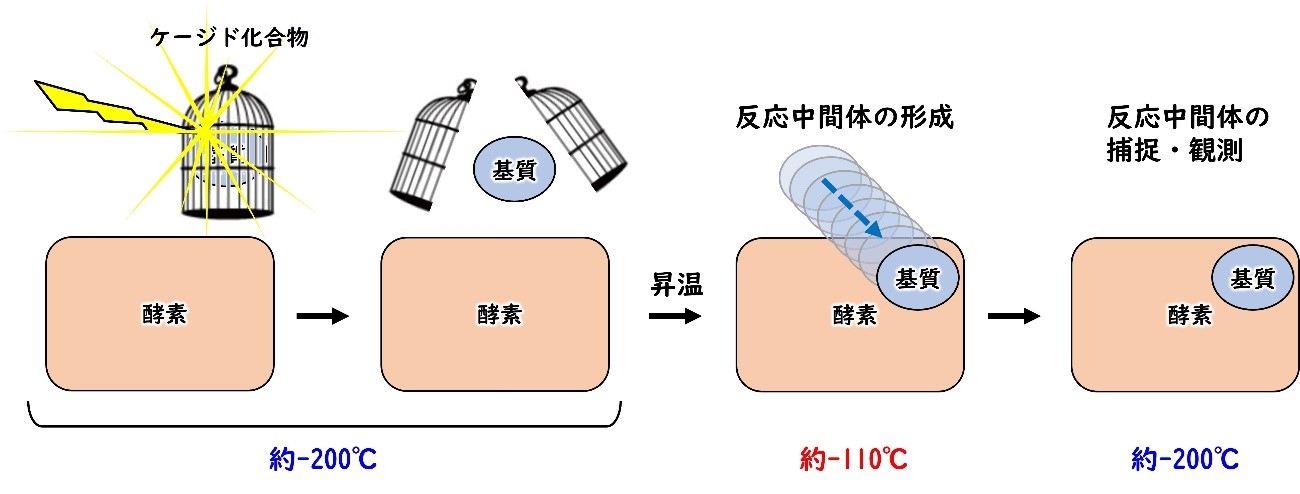
図1 酵素の反応中間体を捕捉する新手法
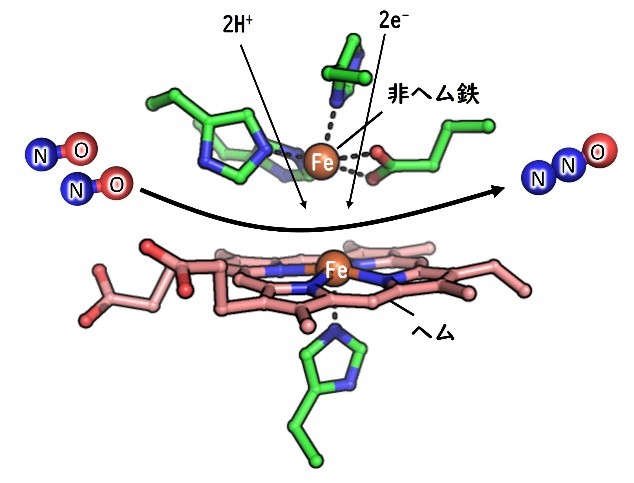
図2. NORの活性部位
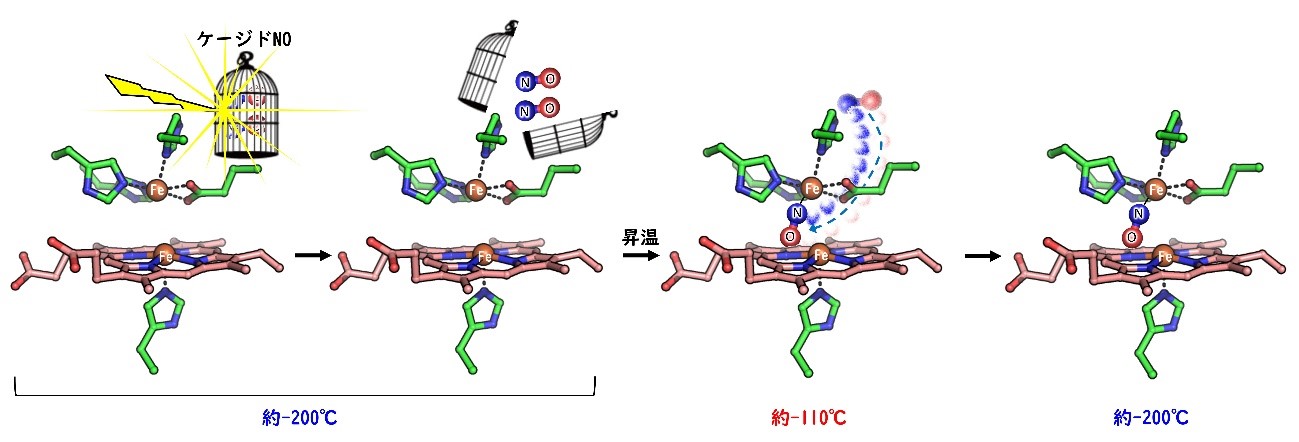
図3. ケージドNOへの低温での光照射と昇温を利用したNORの反応中間体の捕捉
<タイトル>
Trapping of Mono-Nitrosyl Non-Heme Intermediate of Nitric Oxide Reductase by Cryo-photolysis of Caged Nitric Oxide
<著者名>
Hanae Takeda, Kanji Shimba, Masaki Horitani, Tetsunari Kimura, Takashi Nomura, Minoru Kubo, Yoshitsugu Shiro, and Takehiko Tosha
<雑誌>
The Journal of Physical Chemistry B
<DOI>
10.1021/acs.jpcb.2c05852
[1] 一酸化窒素還元酵素
一酸化窒素(NO)を亜酸化窒素(N2O)に変換する酵素。窒素は多くの生物の働きでさまざまな化学形態をとりながら地球上を循環している(窒素循環)。NOからN2Oへの変換はその中の一過程である。N2Oは、フロンに次ぐオゾン層破壊ガスであり、またCO2の300倍の温室効果があるため、一酸化窒素還元酵素の反応機構の解明が待たれている。
[2] 反応中間体
酵素(触媒)が働く途中で形成される活性化された状態。反応性が高いため、マイクロ秒からミリ秒の時間で消失する。
[3] ケージド化合物
光の照射により基質などの化合物を放出する化合物。
[4] 一酸化窒素
ラジカルをもつガス状の二原子分子。反応性に富んでおり、生体内ではシグナル分子として利用される。一方で、種々の生体分子と反応することで細胞損傷を引きおこす。
[5] ヘム鉄
ポルフィリンとよばれる環状の有機分子と鉄が錯体を形成したものをヘムとよび、ヘム分子中の鉄原子のことをヘム鉄とよぶ。酵素の活性中心として機能し、様々な生理反応に関与。
[6] 非ヘム鉄
ヘム鉄とは異なる状態の鉄原子をヘム鉄と区別するために非ヘム鉄とよぶ。
[7] プロトン
水素原子から電子を一つとりのぞいた水素イオン(H+)。
[8] 電子スピン共鳴分光
鉄をはじめとした遷移金属や有機化合物のフリーラジカルなど、不対電子を検出する分光法。
[9] ATP
ATP(アデノシン三リン酸)は、全ての生物が生きるためのエネルギー源として生産・利用している化合物であり、生体のエネルギー通貨と呼ばれている。タンパク質に結合することで作用する。
兵庫県立大学 大学院理学研究科 生命科学専攻
特命教授 城 宜嗣 (シロ・ヨシツグ)
教授 久保 稔 (クボ・ミノル)
大学院生 武田 英恵 (タケダ・ハナエ)
理化学研究所 放射光科学研究センター 生命系放射光利用システム開発チーム
専任研究員 當舎 武彦 (トウシャ・タケヒコ)
佐賀大学 農学部 生物資源科学科 生命機能科学コース
准教授 堀谷 正樹 (ホリタニ・マサキ)
神戸大学 大学院理学研究科 化学専攻
准教授 木村 哲就 (キムラ・テツナリ)
<発表者> ※研究内容については発表者にお問い合わせください。
兵庫県立大学 大学院理学研究科 生命科学専攻
特命教授 城 宜嗣 (シロ・ヨシツグ)
TEL:0791-58-0347(城)
E-mail:yshiro[at]sci.u-hyogo.ac.jp(城)
理化学研究所
放射光科学研究センター 生命系放射光利用システム開発チーム
専任研究員 當舎 武彦 (トウシャ・タケヒコ)
TEL:0791-58-2839(當舎)
E-mail:ttosha[at]spring8.or.jp(當舎)
<機関窓口>
兵庫県立大学 播磨理学キャンパス経営部総務課
TEL:0791-58-0101
E-mail:soumu_harima[at]ofc.u-hyogo.ac.jp
理化学研究所
TEL:050-3495-0247
E-mail:ex-press[at]ml.riken.jp
佐賀大学 広報室
TEL:0952-28-8153
E-mail:sagakoho[at]mail.admin.saga-u.ac.jp
神戸大学総務部広報課
TEL:078-803-5453
E-mail:ppr-kouhoushitsu[at]office.kobe-u.ac.jp
※上記の[at]は@に置き換えてください。